筑牢应急管理之基(下) ——浅析新冠肺炎疫情下中美医疗器械应急监管特点
□ 王佩荣 解怡
我国医疗器械应急审批程序
2003年SARS事件以后,我国构建起围绕应急预案及应急管理体制、机制和法制的“一案三制”应急体系,建立了应急监测预警系统,形成以国务院统一领导、各部门协同的管理模式,并发布多部相关法律法规。
2009年,国家药品监管部门发布《医疗器械应急审批程序》。该程序适用于突发公共卫生事件应急所需,且在我国境内尚无同类产品上市,或虽在我国境内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要,并经国家药监部门确认的医疗器械的审批。
, http://www.100md.com
新冠肺炎疫情防控期间,国家药品监督管理局紧急开辟药品医疗器械应急审批绿色通道,国家药监局医疗器械技术审评中心(以下简称器审中心)迅速成立应急小组,对于提出申请的企业,经过专家组审核和专业技术评估等程序确认后,将其纳入应急审批,并采取提前介入、技术审评、注册检验、体系核查与生产许可同步开展的方式,在确保医疗器械安全和有效的基础上,加快审评审批工作。同时,器审中心及时发布相关指导原则,明确审评要点。如《2019新型冠状病毒核酸检测试剂注册技术审评要点》《2019新型冠状病毒抗原/抗体检测试剂注册技术审评要点(试行)》《肺炎CT影像辅助分诊与评估软件审评要点(试行)》等。此外,2019年6月启用的医疗器械注册电子申报信息化系统在新冠肺炎疫情防控过程中也发挥了重要作用。
为保障疫情防控所需,截至7月16日,国家药监局共应急审批61个新冠肺炎疫情相关产品,其中包括新冠病毒检测试剂盒44个,呼吸机、核酸分析仪等仪器设备13个、核酸分析软件产品1个、硅酮粘胶泡沫敷料等敷料产品3个。对于已通过应急审批程序上市的产品,国家药监局将持续加强上市后监管,密切监测上市后不良事件发生风险,若发生不良事件则及时采取相应措施。
, 百拇医药
中美应急审批体系对比及启示
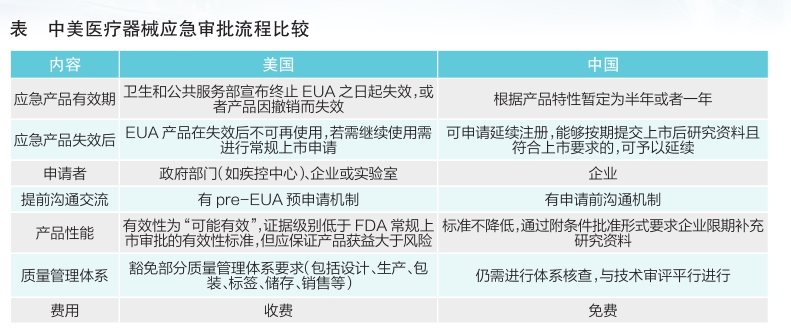
我国医疗器械应急审批制度与美国EUA授权制度均是为应对突发重大公共卫生事件建立的特殊审评制度,两者既有相似之处,亦存在不同(见表)。
综合分析中美两国在疫情防控期间的医疗器械应急监管模式,对我国的应急管理体系建设带来如下启示。
进一步完善应急管理相关政策
为应对因化学、生物、辐射、核威胁及新发传染病造成的突发卫生公共事件,美国FDA采取一系列应急管理政策,注重构建系统的应急管理法律体系。我国具有“政府统筹管理,集中力量办大事”的优势,能够短期协调全国力量,调动大量资源应对突发事件,新冠肺炎疫情防控期间,这一优势得到充分体现且取得显著成效。
目前,国家药监局已针对医疗器械设立创新医疗器械特别审查、优先审批、应急审评审批、附条件批准等特殊通道,结合相关法规和政策,基本可满足我国面对突发公共卫生事件时,应急医疗器械的快速审评审批需求。
, 百拇医药
总结各个国家和地区应对新冠肺炎疫情时采取的积极措施,有助于进一步完善我国应急管理体系,增强我国应对突发公共卫生事件的能力。针对还未发生的潜在重大威胁,也可制定相应应急管理办法,在符合一定条件下将应急前置,最大程度减轻突发公共卫生事件对公众和社会造成的影响。
获益风险评估理念助力科学监管
FDA在进行EUA审评的过程中,会在评估产品已知或潜在获益和风险的同时,考虑突发公共卫生事件造成的危害,形成最终的获益风险评估决定,获益风险评估思维贯穿始终。
我国在疫情防控医疗器械应急审批过程中,同样通过获益风险分析对产品进行综合分析,为最终做出审评决定提供重要依据。今年3月,国家药监局发布《医疗器械安全和性能基本原则》,该原则也将获益风险评估理念贯穿始终,为医疗器械科学监管和科学审评奠定基础。在常规审评和应急审批中科学使用获益风险评估方法,对医疗器械科学监管、科学决策具有重要作用。
, 百拇医药
鼓励创新,增强技术储备
在面对突发公共卫生事件时,需要快速及时解决医疗产品供应紧张等问题,鼓励相关企业积极创新,是解决这一问题的有效途径。实际上,不仅仅是在突发事件发生期间,在非特殊时期,生产企业或科研院所也应着力加强相关领域的科学研究,掌握关键技术,对于可能受到潜在威胁的领域尽早开展研究,形成安全有效的生产和管理体系,增强技术和应急储备。
信息化管理赋能现代化监管
从FDA网站,我们可以查询到已获EUA授权的产品及其相关信息和授权内容。此外,FDA网站还提供应急试剂产品的性能比对信息,以供临床实验室及公众参考。
信息的公开透明化以及方便的检索系统有助于监管部门、医疗机构和公众进行合理判断与使用,我国的信息检索系统及其内容完整性尚需进一步完善。
(作者单位:国家药品监督管理局医疗器械技术审评中心), 百拇医药
参见:首页 > 医疗版 > 疾病专题 > 呼吸内科 > 肺炎